یک روش معمول در عملیات تولید و فرآوری در صنعت نفت و گاز استفاده از جاذب های سولفیدی است. در این حوزه مسئله چالش برانگیز، جستجو و توسعه مواد شیمیایی جدید با هدف حفاظت از سلامت پرسنل و همچنین حفاظت خوب از مواد تحت شرایط مختلف و در عین حال قابل قبول از نظر زیست محیطی است. این مقاله شامل تاریخچه ای به روز از تلاش هایی است که تاکنون در صنعت برای به حداقل رساندن یا حذف مشکلات مختلف ناشی از سولفید هیدروژن در حین عملیات حفاری نفت و گاز با استفاده از برخی مواد شیمیایی انجام شده است. همچنین در ادامه به مزایا و معایب استفاده از مواد شیمیایی مختلف برای مهار سیالات حفاری سولفید هیدروژن و سیالات تولیدی پرداخته شده است.

گاز سولفید هیدروژن
سولفید هیدروژن گازی بی رنگ با بوی بد و طعم شیرین است. در آب، الکل، روغن ها و بسیاری از حلال های دیگر محلول است.
وزن مخصوص آن با توجه به هوا 1.1895 است و یک اسید ضعیف در نظر گرفته می شود. برای انسان و حتی حیوانات بسیار سمی است. برای اکثر فلزات بسیار خورنده است زیرا می تواند باعث ترک خوردن لوله های حفاری و تخریب ابزارهای آزمایش و خطوط سیم شود. محتوای سولفید هیدروژن سیالات در چاه های نفت تأثیر مهمی بر ارزش اقتصادی هیدروکربن های تولیدی و عملیات تولید دارد.
به طور معمول، محتوای گوگرد نفت خام در محدوده 0.3-0.8 درصد وزنی و محتوای سولفید هیدروژن گاز طبیعی در محدوده 0.01-0.4 درصد وزنی است، اگرچه غلظت سولفید هیدروژن در گاز طبیعی تا 30 درصد وزنی گزارش شده است. چندین گزارش اخیر مدعی افزایش سیستماتیک محتوای گوگرد نفت خام طی 10 تا 20 سال گذشته بوده و افزایش قابل توجه بیشتر در غلظت سولفید هیدروژن در نفت و گاز طبیعی را پیش بینی کرده است.
ارتباط بین غلظت سولفید هیدروژن و هیدروکربن های تولید شده نشان می دهد که محتوای سولفید هیدروژن هیدروکربن های تولید شده در دمای 110 درجه به طور تصاعدی با دما افزایش می یابد، در حالی که در زیر این دما غلظت سولفید هیدروژن ناچیز است. هنگامی که سولفید هیدروژن در حین حفاری، تکمیل یا آزمایش هیدروکربن ها وارد می شود، مشکلات بسیار زیادی ایجاد می کند. این مشکلات بدون توجه به منبع سولفید هیدروژن مشکلات زیادی را در میدان نفتی ایجاد کرده است.
منشا سولفید هیدروژن
در طول عملیات نفت و گاز، سولفید هیدروژن را می توان به عنوان جزئی از گاز های تشکیل، محلول در آب، هیدروکربن ها یا حتی گوگرد مایع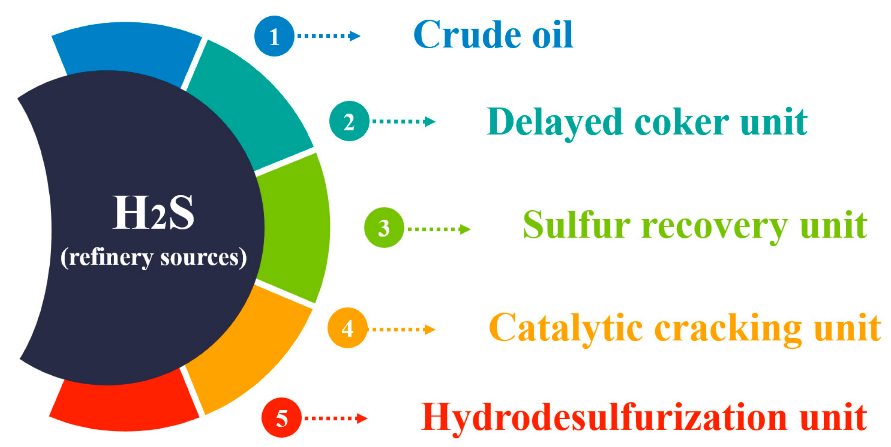 یافت. تخریب حرارتی مواد آلی و باکتری های کاهنده سولفات می تواند سولفید هیدروژن را همراه با گاز های دیگر ایجاد کند. واحد های بازیافت سولفور و کراکینگ کاتالیتکی از جمله واحد های تولید کننده گاز سولفید هیدروژن می باشند.
یافت. تخریب حرارتی مواد آلی و باکتری های کاهنده سولفات می تواند سولفید هیدروژن را همراه با گاز های دیگر ایجاد کند. واحد های بازیافت سولفور و کراکینگ کاتالیتکی از جمله واحد های تولید کننده گاز سولفید هیدروژن می باشند.
مشکلات ناشی از گاز سولفید هیدروژن
تاثیر سولفید هیدروژن بر انسان
یکی از مشکلات اساسی که سولفید هیدروژن ایجاد می کند، رعایت بهداشت و ایمنی پرسنل است. حداکثر هشت ساعت قرار گرفتن در معرض غلظت های بیشتر از ppm 100 سولفید هیدروژن باعث خونریزی و مرگ می شود. غلظت بالای ppm 600 سولفید هیدروژن می تواند در عرض سه تا پنج دقیقه کشنده باشد. در غلظت های بالای ppm 100 ، حس بویایی فرد در عرض چند دقیقه از بین می برد. گاز خالص سنگین تر از هوا است و می تواند در مناطق کوچک مانند اتاق های محل اقامت و گودال جمع شود. در جدول (1) تاثیر گاز سولفید هیدروژن بر انسان آمده است.
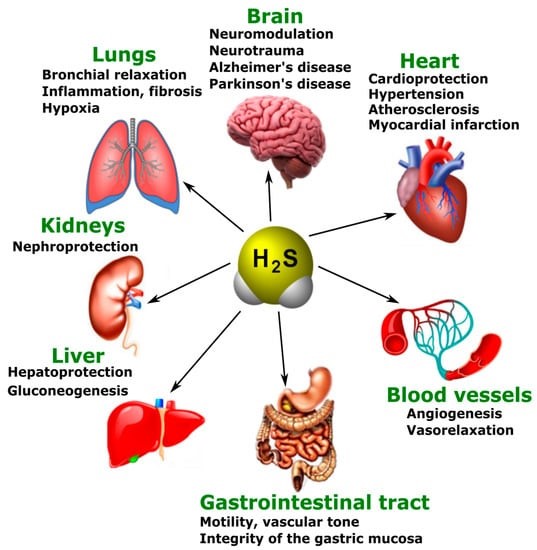
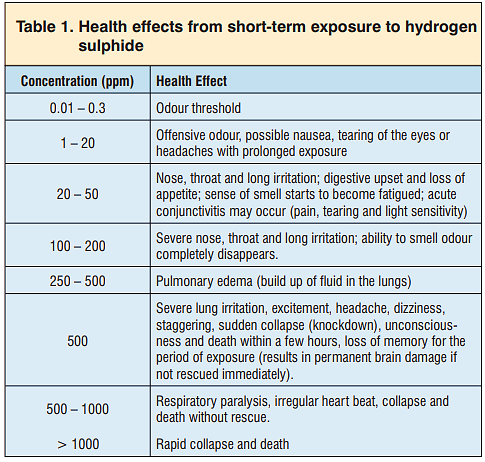
تاثیر سولفید هیدروژن بر فلزات
سولفید هیدروژن عمدتاً باعث ایجاد مشکلات خوردگی در تجهیزات حفاری، لولههای انتقال، مخازن ذخیرهسازی و غیره میشود. فولاد با استحکام بالا در فشار بالا و در حضور ppm 50 سولفید هیدروژن در عرض چند دقیقه از بین می رود. در فشار بالا، کاهش ppm 0.1 سولفید هیدروژن می تواند زمان شکست فولاد تحت فشار را تا حد زیادی کاهش دهد. خوردگی آهن در حضور سولفید هیدروژن و آب به تفکیک مولکول هیدروژن سولفید بستگی دارد. آهن در آند به شکل آهن اکسید می شود و سولفید هیدروژن در کاتد دچار تفکیک دو مرحله ای می شود.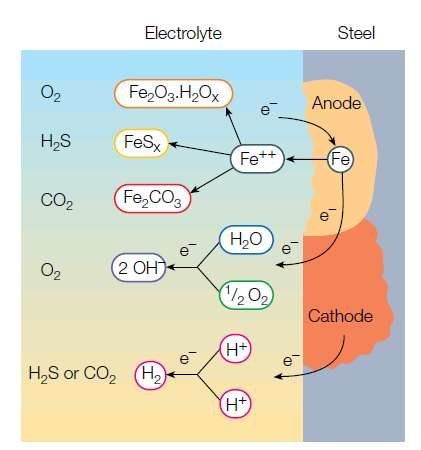
تونگ و همکاران واکنش های تعادلی زیر را پیشنهاد میکنند. در کاتد هیدروژن تولید می شود که یا وارد فولاد می شود یا گاز هیدروژن و حباب ایجاد می کند:
Fe → Fe2+ + 2e-
2H+ + 2e- → Ho + Ho
اگر سولفید هیدروژن وجود نداشته باشد:
Ho + Ho → H2 (gas)
هیدروژن ابتدا با جذب سطحی آب به فولاد وارد فولاد می شود و سپس به صورت هیدروژن در فولاد جذب می شود. مقدار ورود هیدروژن به نرخ خوردگی سطح فولاد و غلظت آنیون هایی مانند HS- بستگی دارد که تمایل به تولید گاز هیدروژن را کاهش می دهد (همانطور که در معادله دوم بالا نشان داده شده است).
pH نیز بر میزان آسیب خوردگی تأثیر دارد. اساساً اصطلاح "سولفید ها" مورد استفاده در عملیات نفت و گاز شامل هر سه گونه محلول در آب، H2S، HS-و S2- است که در یک سیستم سولفید-آب همزیستی دارند. در نمودار یونیزاسیون سولفید هیدروژن در شکل 1 می توان مشاهده کرد که H2S مولکولی در محدوده اسیدی، جایی که pH زیر 7 است، غالب است. در محدوده 7 تا 12، HS- تک ظرفیتی و بالاتر از pH 12 ، - S 2 دو ظرفیتی غالب است. تصویر شکل 1 نشان می دهد که مهمترین عمل این است که وقتی سولفید هیدروژن وارد گل قلیایی می شود، واکنش نشان می دهد و یک سولفید قلیایی، اغلب سولفید سدیم، تشکیل می دهد. در حالی که pH بالا راه خوبی برای جلوگیری از ایجاد مشکل سولفید هیدروژن در شرایط خاص است اما آن را از مایع خارج نمی کند و هر افت pH می تواند خطر قابل توجهی ایجاد کند. این مشکلات باعث ظهور جاذب های سولفید در حوزه نفت و گاز شد.
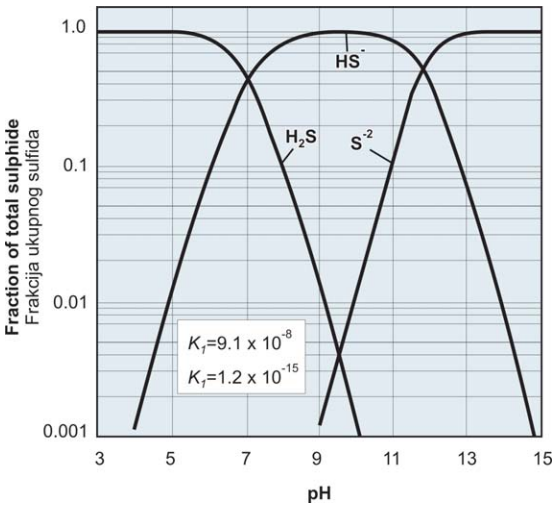
شکل 1- توزیع سولفید ها بر اساس تغییر pH
تنها روش ایمن برای حذف کامل سولفید هیدروژن یا سولفید های محلول، استفاده از جاذب سولفید است.
فناوری جذب سولفید هیدروژن
اصطلاح " جاذب (اسکونجر)" به هر ماده شیمیایی (معمولا یک افزودنی تجاری) اشاره دارد که می تواند با یک یا چند گونه سولفید واکنش داده و آن ها را به شکل بی اثرتری تبدیل کند. مهار موثر بر اساس دستیابی به یک واکنش شیمیایی غیرقابل برگشت و کامل بین جاذب و یک یا چند گونه سولفید است. از آنجایی که یک تعادل متقابل بین سه گونه در محلول وجود دارد، حذف کامل غیرقابل برگشت یک گونه به حذف هر سه گونه کمک می کند. واکنش شیمیایی ناقص بین یک گونه و جاذب نمی تواند تمام سولفید های محلول موجود را حذف کند.
اکثر جاذب های سولفید هیدروژن به روش جذب سطحی یا از طریق هم رسوبی یونی عمل می کنند. اگر جاذب مورد استفاده بر اساس تکنیک جذب سطحی باشد، گل باید در جریان ثابت باشد تا اطمینان حاصل شود که افزودنی و سولفید ها واقعاً با یکدیگر برخورد می کنند تا واکنش های لازم انجام شود. یک وضعیت جریان متلاطم برای این امر ایده آل است و بسیاری از برخورد های تصادفی دو ذره را تضمین می کند. هنگامی که جاذب بر اساس یک واکنش یونی است، ویژگی های جاذب باید مد نظر قرار گرفته شود تا اطمینان حاصل شود که متغیر هایی مانند pH و شوری برای استفاده از افزودنی مفید هستند. قبل از اینکه یک جاذب خاص انتخاب شود، باید شکل سولفید هایی را که در یک سیستم گلی خاص وجود دارد، مشخص شود. در اکثر شرایط، سولفید ها به یکی از سه شکل مختلف بسته به فاکتور pH گل وجود خواهند داشت. اکثر مقررات دولتی ایجاب می کنند که حداقل سطح pH=10 همیشه در محیط H2S حفظ شود. عموماً، در حال حاضر تنها دو نوع جاذب در صنعت حفاری به بازار عرضه می شوند: مواد شیمیایی حاوی روی و اکسید آهن (Fe3O4) .سایر مواد شیمیایی تجاری نیز برای این کار در دسترس هستند، اما دو مورد فوق الذکر در جمع آوری سولفید در صنعت نفت و گاز بیشترین کارایی را دارند.
یک جاذب ایده آل باید ویژگی های زیر را داشته باشد:
- واکنش آن با سولفید باید کامل، سریع و قابل پیش بینی باشد. محصول(های) واکنش تشکیل شده باید در تمامی شرایط گل بی اثر بماند.
- جذب باید در طیف وسیعی از محیط های شیمیایی و فیزیکی سیستم رخ دهد. این شامل طیف گستردهای از pH، دما، فشار، واکنشهای رقابتی است.
- عملکرد کلی سیستم، به عنوان مثال رئولوژی گل، فیلتراسیون و کیفیت کیک نباید در اثر استفاده از بیش از حد جاذب در سیستم، حتی در دما های بالا، مختل شود.
- مقدار واقعی جاذب موجود برای واکنش در گل باید ظرفیت اندازه گیری سریع و آسان در محل حفاری را داشته باشد.
- جاذب و همچنین محصولات واکنش آن باید در برابر فلزات و موادی که با گل تماس دارند غیرخورنده باشند.
- استفاده از جاذب نباید ایمنی و سلامت پرسنل را به خطر بیندازد یا محیط زیست را آلوده کند. برعکس، جاذب باید حفاری در مناطق سولفید هیدروژن یا فرآیند های شیرین سازی را ایمن تر کند.
- جاذب باید به طور گسترده در دسترس و از نظر اقتصادی مقرون به صرفه برای پذیرش صنعت به علاوه راندمان بالا برای واکنش سولفید در همه شرایط استفاده باشد.
جاذب های سولفید هیدروژن قابل استفاده در صنعت چیست؟
اولین نسل از جاذب های سولفید هیدروژن که در متون قابل مشاهده است، مواردی هستند که ابتدا مورد بحث قرار میگیرند.
در عملیات حفاری برای حذف سولفید هیدروژن از ترکیبات مس، به ویژه کربنات مس استفاده شده است. در واقع اگر به گل های پایه آب اضافه شود، سولفید هیدروژن به صورت سولفید مس نامحلول بر اساس معادله زیر رسوب می کند.
CuCO3 + H2S → CuS + H2O + CO2
اگرچه، آزمایشها نشان دادهاند که واکنش آن با سولفید بسیار سریع و کارآمد است، استفاده از آن بهعنوان پیش تصفیه در حین عملیات حفاری غیرعملی است، زیرا مس روی هر ماده فرتتیکی قرار می گیرد و یک سلول خوردگی ایجاد میکند. گزارش ها حاکی از آن است که این جاذب ها به همین دلیل مشکلات خوردگی زیادی در زمینه های تولید ایجاد کرده اند. علاوه بر این، می توان نتیجه گرفت که ترکیبات مس را می توان برای حذف سولفید هیدروژن در جایی که هیچ تماسی با مواد فریتی وجود ندارد، به عنوان مثال اگر سولفید هیدروژن به دلیل هجوم زیاد گاز به سطح آورده شود، استفاده کرد.
پراکسید هیدروژن همچنین به عنوان یک افزودنی به گل در خط جریان برای تبدیل سولفید هیدروژن به گوگرد آزاد با توجه به واکنش پیشنهاد شده است:
H2O2 + H2S → S0 + H2O
شیمی واکنش صحیح است اما کاربرد عملی آن بسیار محدود است زیرا پراکسید هیدروژن با سایر اجزای سیستم بیش از حد واکنش پذیر است. به همین دلیل، حذف رضایت بخش سولفید هیدروژن غیرممکن خواهد بود.
روش دیگر افزودن مواد شیمیایی حاوی روی است. اکسید روی (ZnO)، کربنات روی (ZnCO3) و کربنات روی بازیک (Zn5(OH)6(CO3)2) هنوز برای این کار در صنعت استفاده می شود. (برای تهیه کربنات روی با کارشناسان ما تماس بگیرید).

حلالیت ZnO و ZnCO3 به سرعت در pH بالا یا pH پایین افزایش می یابد زیرا ماهیت آمفوتری دارند. اما روی بازیک در هر دو انتهای مقیاس pH محلول است. اگر pH گل بالاتر از حدود 11 باشد (همانطور که معمولاً در حفاری انجام می شود)، یون های روی تشکیل می شوند که حلالیت کربنات روی بازیک را تا حد زیادی افزایش می دهد.
Zn2+ + 3OH- → Zn(OH)3-
Zn(OH)3- + OH- → Zn(OH)4
با توجه به این پدیده، یک جاذب با پایه روی می تواند به طور کامل در گل های با pH بالا حل شود و غلظت بالایی از یون های روی یا روی برای رسوب سریع و کامل سولفید ها ایجاد کند. این امر باعث کارآمدی جاذب های بر پایه روی می شود.
ترکیبات آهن نیز برای حذف سولفید در حین حفاری یا در سیالات ایجاد شده آزمایش و تا به امروز مورد آزمایش قرار گرفتند. تنها مواد شیمیایی غیر آلی پایه آهن که در حال حاضر به عنوان جاذب در حفاری و سیالات تولیدی استفاده می شود، اکسید های آهن هستند که هم در آب و هم در گل نامحلول هستند. مکانیسم واکنش بین اکسید های آهن و سولفید های محلول که باعث تشکیل ترکیبات مختلف آهن-گوگرد می شوند، ممکن است شامل تغییرات در حالت اکسیداسیون، یا ایجاد ترکیباتی جدید باشد. با این حال، برخی از متخصصان حفاری، تحقیقات زیادی در مورد فناوری مهار اکسید های آهن انجام داده اند و به این نتیجه رسیده اند که اکسید آهن مغناطیسی مصنوعی با نام تجاری ironite sponge یا مگنتیت (Fe3O4) در میان اکسید های آهن برای کار های مهار سولفید بخصوص در pH پایین اثر بخشی بالایی دارد.
Fe3O4 + 6H2S - → 3FeS2 + 4H2O + 2H2
این محدودیت اجازه نمی دهد که مگنتیت به عنوان جاذب ایده آل در نظر گرفته شود. جستوجوی برای جاذب ایدهآل همچنان ادامه دارد. اخیراً برخی از یافته های انجامشده نشان می دهد فروس گلوکونات کارآمد و از نظر زیست محیطی بی خطر است، اما آزمایشات کامل و بررسی در محیط های غیر حفاری صورت نگرفته است.
Fe (C6H12O7)2 + S2- → FeS + 2 C6H12O7-
شرکت اکسیرسازان نیک اندیش، تولید کننده و تامین کننده تخصصی مواد شیمیایی، جهت ارائه محصولات با کیفیت در خدمت شما می باشد. برای کسب اطلاعات بیشتر با ما در تماس باشید.
منابع:
Amosa MK, Mohammed IA, Yaro SA. Sulphide scavengers in oil and gas industry–a review. Nafta. 2010 Jan;61(2):85-92
Al-Humaidan, A. Y., Nasr-El-Din, H. A., “Optimization of Hydrogen Sulphide Scavengers Used During Well Stimulation” SPE Paper, Intl. Symp. On Oilfield Chemistry, Texas, Feb. 16-19, 1999, Pp 2.
Alan, A. G., Read, P. A., Wilson, R. D.,”Evaluation and Field Application of A New Hydrogen Sulphide Scavenger”, 10th Int’l Oilfield Chemical Symp., Norway, March 1-3, 1999. Pp 1-4.
Alvin, S., “H2S Need Not be Deadly, Dangerous, Destructive," SPE Journal 5202, November, 1974, Pp 150
Amosa, M. K., “Comparative Analysis of Hydrogen Sulphide Scavenging Effects of Ferrous Gluconate and Magnetite in Oil and Gas Drilling Fluids”, Unpublished MSc Thesis, Ahmadu Bello University, Zaria, Nigeria, 2009.
Carney, L. L., and Jones, B., “Practical Solutions to Combat the Detrimental Effects of H2S During Drilling Operations”, SPE Journal 5198, Nov., 1974. Pp 115-117. 6. Carter, D. R., and Adams N. J., "Hydrogen Sulphide in the Drilling Industry" SPE Journal, Symp. On Deep Drilling and Production, Texas, April 1-3, 1979, Pp 125-128.